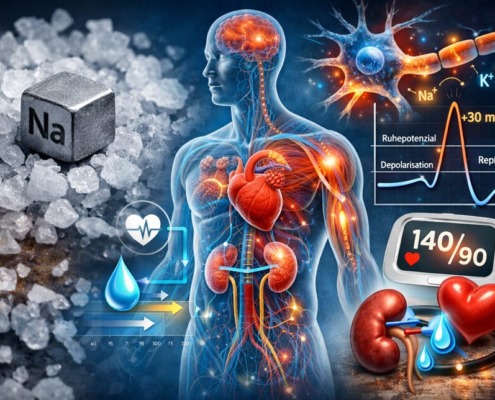
Natrium im Körper: Funktion, Bedarf und Risiken verständlich erklärt
Salz gilt als der Bösewicht auf dem Teller. Zu viel davon, heißt es, treibt den Blutdruck hoch, schadet dem Herzen und gehört möglichst verbannt. Punkt. So einfach macht man es sich gern. In der Praxis ist die Sache deutlich unbequemer –…
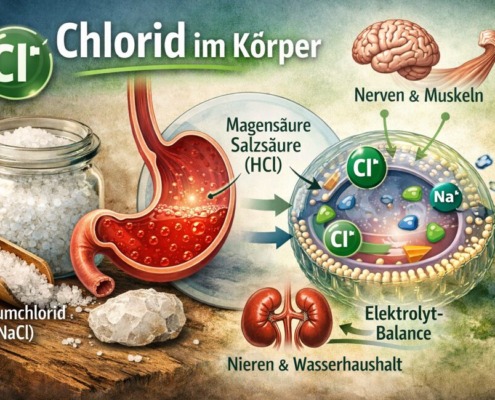
Chlor im Körper: Warum Chlorid lebenswichtig ist
Chlor im Körper: Warum Chlorid lebenswichtig ist
Chlor gilt vielen als Inbegriff des Gefährlichen: stechendes Gas, Gift, Desinfektionskeule. Im Schwimmbad riecht man es, in der Industrie fürchtet man es, und in der Gesundheitsdebatte…

Magnesium gegen Calcium: Über das richtige Verhältnis
Wer von gesunden Knochen redet, der wird schnell auf die Notwendigkeit von Calcium zu sprechen kommen. Dabei sind Calcium- und Magnesiummangel (Hypokalzämie, Hypomagnesiämie) eine umfassende Bedrohung der Gesundheit.
Es gibt wohl kein Produkt…

Mineralstoffmangel in Gemüse: Warum unsere Nahrung nicht mehr das liefert, was sie sollte
In dieser kompakten Video-Sequenz teile ich mit Ihnen meine Sicht auf die Problematik mit Mineralstoffmangel in unserem Gemüse:
Wussten Sie, dass der Mineralstoffgehalt in Gemüse seit 1914 dramatisch gesunken ist? Diese…
Eisen – Eigenschaften – Bedarf des Menschen – Symptome bei Eisenmangel und mehr
Eisen – Eigenschaften – Bedarf des Menschen – Symptome bei Eisenmangel und mehr
Eisen ist das technisch wichtigste Metall. Wir kennen es als Stahl, Blech usw. Ohne Eisen als Ausgangsstoff wären viele unserer heutigen Gebrauchsgegenstände…

Phosphor im Körper & Phosphat in der Ernährung: Warum das richtige Kalzium-Phosphor-Verhältnis entscheidend ist
Phosphor und Phosphate - ein Problem? Hier in Zusammenfassung worum es geht:
Also: Phosphor ist ein lebenswichtiges Mineral, das in jeder Zelle unseres Körpers vorkommt. Es spielt eine zentrale Rolle im Energiestoffwechsel, bei der Bildung…

MSM: organischer Schwefel mit heilender Wirkung
Dimethylsulfon oder Methylsulfonylmethan (C2H6O2S abgekürzt MSM) ist eine einfache schwefelorganische Verbindung, die auch von Organismen produziert wird.
Daher ist MSM in geringen Konzentrationen Bestandteil von Lebensmitteln. So beträgt…
Tribasisches Magnesiumcitrat
Tribasisches Magnesiumcitrat ist eine Variante des "normalen" Magnesiumcitrats mit einigen veränderten Eigenschaften. Während beim Magnesiumcitrat zwei Komponenten miteinander verbunden sind, nämlich Magnesium und ein Citrat(Zitronensäure)-Molekül,…

Für was ist Magnesium alles gut? Wann soll man es einnehmen?
Für was ist Magnesium alles gut? Wann soll man es einnehmen?
Magnesium ist das am meisten unterschätze Mineral im Körper. Und es steht im Schatten von Kalzium, Kalium und Natrium. Zumindest in der klinischen Praxis.
Ein Grund…

Magnesiumpräparate – Welches Magnesium ist das Beste?
Bevor ich zur Frage komme welches Magnesium-Präparat das Beste ist, vorweg einige Anmerkungen zu diesem Mineralstoff.
Magnesium ist ein Erdalkali-Metall, das mit einem Massenanteil von rund 2 % in der Erdkruste vorkommt. Obwohl das nach…
