Glutathion – Das wichtigste Antioxidans des Körpers
Glutathion ist ein zentrales Antioxidans, das die Entgiftung in Leber und Nieren unterstützt, die Zellen vor oxidativem Stress schützt und eine essenzielle Rolle im Immunsystem spielt. Nahrungsergänzungsmittel mit Glutathion werden oft mit einem Anti-Aging-Effekt beworben. Doch welche Wirkungen sind wissenschaftlich belegt?
Was ist Glutathion?
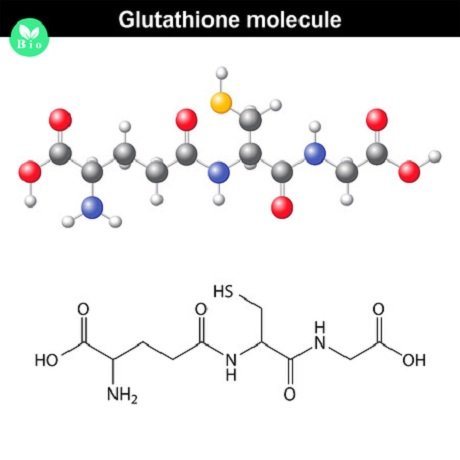
Glutathion (GSH) ist ein Tripeptid, das aus den Aminosäuren Glutaminsäure, Cystein und Glycin besteht. Diese Verbindung wirkt als starkes Antioxidans, das freie Radikale neutralisiert und Zellschäden verhindert. Glutathion ist zudem an der Entgiftung beteiligt und unterstützt das Immunsystem.
Der Körper kann Glutathion selbst synthetisieren, jedoch nimmt seine Produktion mit zunehmendem Alter und unter Belastung durch Umweltgifte ab. Ein niedriger Glutathion-Spiegel wird mit verschiedenen chronischen Erkrankungen in Verbindung gebracht.
Glutathion und seine Funktionen im Körper
- Antioxidative Wirkung und Zellschutz
Glutathion ist das wichtigste intrazelluläre Antioxidans. Es verhindert Zellschäden durch oxidative Prozesse und reduziert Entzündungen. Studien zeigen, dass ein niedriger Glutathion-Spiegel mit erhöhtem oxidativen Stress in Verbindung steht, was wiederum das Risiko für Herz-Kreislauf-Erkrankungen, Diabetes und neurodegenerative Krankheiten erhöht (Wu et al., 2004; Pizzorno, 2014).
- Entgiftung und Biotransformation
Glutathion spielt eine zentrale Rolle in der Entgiftung und ist an der Biotransformation in der Leber beteiligt. Es hilft, Schwermetalle wie Quecksilber und Blei zu binden und auszuscheiden (James et al., 2005). Zudem ist es ein wichtiger Bestandteil der Phase-II-Entgiftung, bei der schädliche Substanzen für den Körper unschädlich gemacht werden (Lu, 2013).
Übrigens: Wenn Sie solche Informationen interessieren, dann fordern Sie unbedingt meinen kostenlosen Praxis-Newsletter „Unabhängig. Natürlich. Klare Kante.“ dazu an:
- Unterstützung des Immunsystems
Glutathion reguliert die Funktion der Lymphozyten und verstärkt die Immunantwort. Eine Studie von Droge et al. (1994) zeigte, dass niedrige Glutathion-Spiegel mit einer geschwächten Immunabwehr korrelieren. Dies ist besonders bei älteren Menschen und immungeschwächten Patienten von Bedeutung.
- Neuroprotektive Eigenschaften
Das Gehirn ist besonders anfällig für oxidativen Stress. Glutathion schützt Nervenzellen vor Degeneration und wird als potenzielles Mittel zur Prävention von Alzheimer und Parkinson diskutiert (Bains & Shaw, 1997). Studien zeigen, dass niedrige Glutathion-Spiegel im Gehirn mit einem höheren Risiko für neurodegenerative Erkrankungen verbunden sind (Gu et al., 1998).
Glutathion-Mangel
Ein niedriger Glutathion-Spiegel kann durch verschiedene Faktoren verursacht werden, darunter:
- Chronischer Stress und Entzündungen
- Umweltgifte und Schwermetalle
- Alterungsprozesse
- Hoher Alkoholkonsum und Rauchen
- Bestimmte Erkrankungen wie Diabetes und Krebs
Ein Glutathion-Mangel kann zu erhöhtem oxidativen Stress führen, die Immunabwehr schwächen und das Risiko für chronische Erkrankungen steigern (Lang et al., 2000).
Glutathion in Lebensmitteln
Obwohl der Körper Glutathion selbst produzieren kann, ist eine ausreichende Zufuhr von Vorläuferstoffen wichtig. Besonders cysteinreiche Lebensmittel unterstützen die Glutathion-Synthese. Gute Quellen sind:
- Knoblauch und Zwiebeln
- Brokkoli, Kohl und Spargel
- Eier, Fisch und Fleisch
- Walnüsse und Paranüsse
Glutathion als Nahrungsergänzungsmittel
Supplemente mit Glutathion sind in Form von Kapseln, Pulvern und liposomalem Glutathion erhältlich. Studien zeigen jedoch, dass die orale Bioverfügbarkeit begrenzt ist, da Glutathion im Darm gespalten wird (Witschi et al., 1992). Alternativ können Vorläuferstoffe wie N-Acetylcystein (NAC) eingenommen werden, die die endogene Glutathion-Produktion erhöhen.
Dosierung
Die empfohlene Tagesdosis liegt zwischen 250 und 1000 mg, je nach Gesundheitszustand und Bedarf. Bei Infusionen, die eine höhere Bioverfügbarkeit haben, werden meist 600 bis 2000 mg pro Anwendung gegeben.
Mögliche Nebenwirkungen
Glutathion ist gut verträglich, jedoch kann eine übermäßige Supplementation Kopfschmerzen oder Magen-Darm-Beschwerden verursachen. Patienten mit schweren Leber- oder Nierenerkrankungen sollten die Einnahme mit ihrem Arzt besprechen.
Fazit
Glutathion ist eines der wichtigsten Antioxidantien im Körper und spielt eine entscheidende Rolle für Zellschutz, Entgiftung und das Immunsystem. Eine gesunde Lebensweise, eine nährstoffreiche Ernährung und gezielte Supplementation können helfen, einen optimalen Glutathion-Spiegel aufrechtzuerhalten. Insbesondere bei oxidativem Stress oder chronischen Erkrankungen kann eine gezielte Einnahme sinnvoll sein.
Übrigens: Wenn Sie solche Informationen interessieren, dann fordern Sie unbedingt meinen kostenlosen Praxis-Newsletter „Unabhängig. Natürlich. Klare Kante.“ dazu an.
Übrigens: Wenn Sie solche Informationen interessieren, dann fordern Sie unbedingt meinen kostenlosen Praxis-Newsletter „Unabhängig. Natürlich. Klare Kante.“ dazu an:
Quellen
- Bains, J. S., & Shaw, C. A. (1997). Neurodegenerative disorders in humans: the role of glutathione in oxidative stress-mediated neuronal death. Brain research reviews, 25(3), 335-358.
- Droge, W., et al. (1994). Role of Glutathione in Immune System. Biochemical Pharmacology, 47(10), 1691-1695.
- James, S. J., et al. (2005). Mechanisms of mercury-induced toxicity. Toxicology and applied pharmacology, 206(2), 119-128.
- Lu, S. C. (2013). Glutathione synthesis. Biochimica et Biophysica Acta (BBA)-General Subjects, 1830(5), 3143-3153.
- Wu, G., et al. (2004). Glutathione metabolism and its implications for health. The Journal of Nutrition, 134(3), 489-492.
Beitragsbild: 123rf.com – Anton Lebedev
 Rene Gräber:
Rene Gräber:
Ihre Hilfe für die Naturheilkunde und eine menschliche Medizin! Dieser Blog ist vollkommen unabhängig, überparteilich und kostenfrei (keine Paywall). Ich (René Gräber) investiere allerdings viel Zeit, Geld und Arbeit, um ihnen Beiträge jenseits des „Medizin-Mainstreams“ anbieten zu können. Ich freue mich daher über jede Unterstützung! Helfen Sie bitte mit! Setzen Sie zum Beispiel einen Link zu diesem Beitrag oder unterstützen Sie diese Arbeit mit Geld. Für mehr Informationen klicken Sie bitte HIER.

 Rene Gräber:
Rene Gräber: